Nature子刊:香港大学周婕团队利用新型呼吸道类器官首次实现人类鼻病毒C型的连续传代及深入研究
来源:生物世界 2025-01-07 14:11
研究团队利用他们开发的人呼吸道类器官,首次成功实现了HRV-C的连续传代培养,并揭示了病毒-宿主间的相互作用机制。
香港大学微生物系周婕、袁国勇教授团队,联合类器官技术先驱 Hans Clevers 教授,在 Nature Communications 期刊发表了题为:Human respiratory organoids sustained reproducible propagation of human rhinovirus C and elucidation of virus-host interaction 的研究论文。

研究团队利用他们开发的人呼吸道类器官,首次成功实现了HRV-C的连续传代培养,并揭示了病毒-宿主间的相互作用机制。
研究团队首先成功使用气道类器官(Airway Organoid)从确诊患者鼻咽拭子样本中分离出了HRV-C(成功率88.9%)(图1)。从气道类器官分离培养的第一代病毒样本被收集并用作连续传代的接种液。然而结果显示,尽管气道类器官能够从样本中分离到病毒,但却无法支持HRV-C的连续传代(图1)。只有在小分子化合物介导的免疫抑制条件下,气道类器官才能支持HRV-C的连续传代(图2)。相比之下,鼻粘膜类器官(Nasal Organoid)则可在无需任何干预的情况下实现稳定传代(图3)。 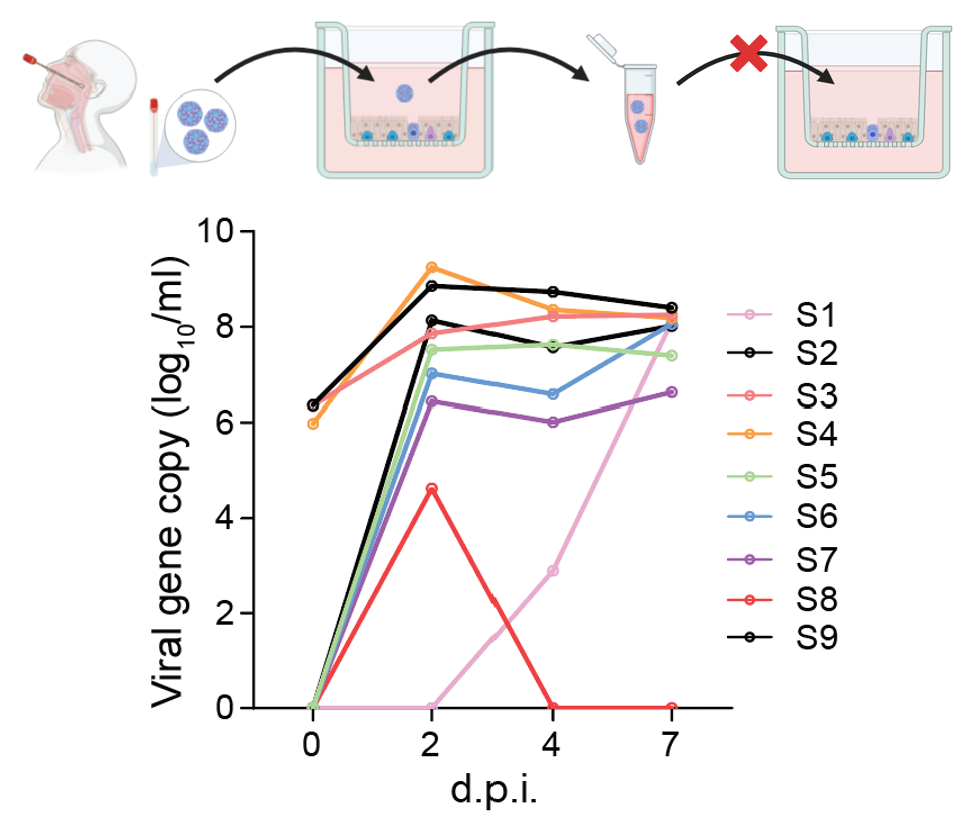
图1. 利用气道类器官从临床样本中分离HRV-C
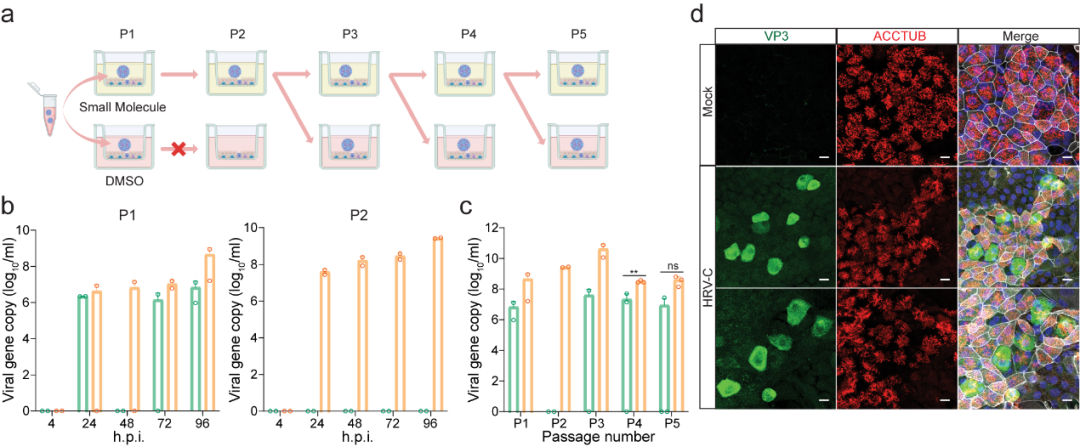
图2. 利用气道类器官对HRV-C进行连续传代
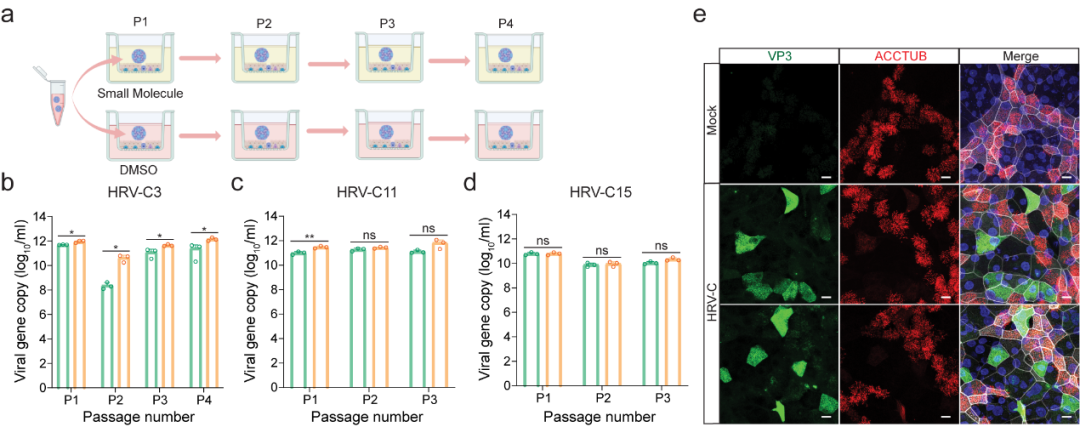
图3. 利用鼻粘膜类器官对HRV-C进行连续传代
鉴于 HRV-C 在气道类器官和鼻粘膜类器官中的复制和扩增对小分子化合物所介导的免疫抑制作用的依赖性存在差异,研究团队推测鼻粘膜类器官对HRV-C应该更加易感。
为了验证这一假设,他们使用不同量的HRV-C对这两种类器官进行感染,并对比病毒复制的情况。结果显示,在高病毒量感染下(1000 copy/cell和100 copy/cell),HRV-C在气道类器官中的复制能力显著低于鼻粘膜类器官;而在低病毒量感染时(10 copy/cell和1 copy/cell),只有鼻粘膜类器官能够支持HRV-C的复制(图4a)。此外,流式细胞术分析也显示HRV-C在鼻粘膜类器官中的感染率更高(图4b)。
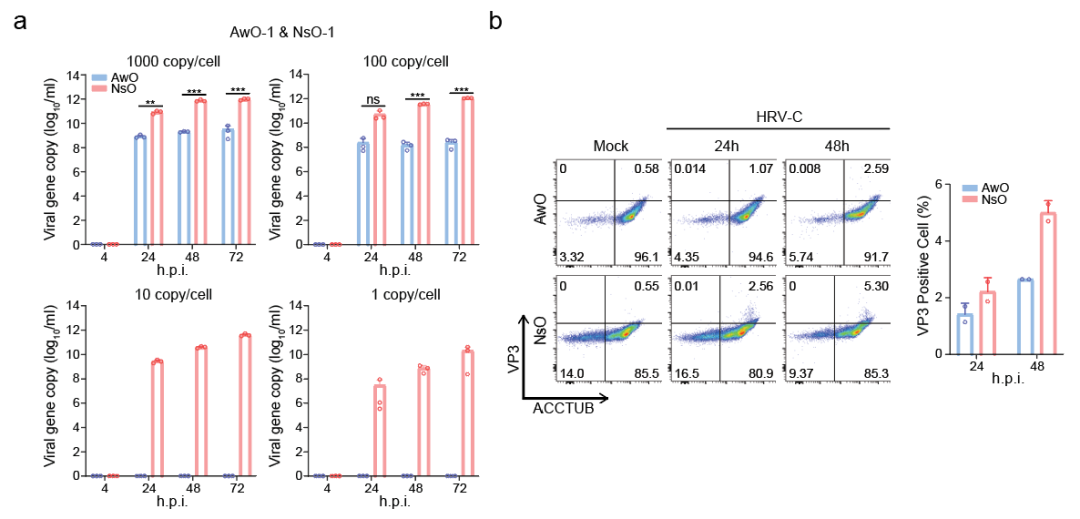
图4. 鼻粘膜类器官比气道类器官对HRV-C更易感
为进一步探究气道和鼻粘膜类器官对HRV-C不同易感性的机制,研究团队对感染HRV-C的类器官进行了转录组测序分析。结果显示,气道类器官中诱导的抗病毒基因和炎症细胞因子等的表达水平显著高于鼻粘膜类器官,且这些差异表达的基因与“先天性免疫反应”和“抗病毒反应”相关(图5)。
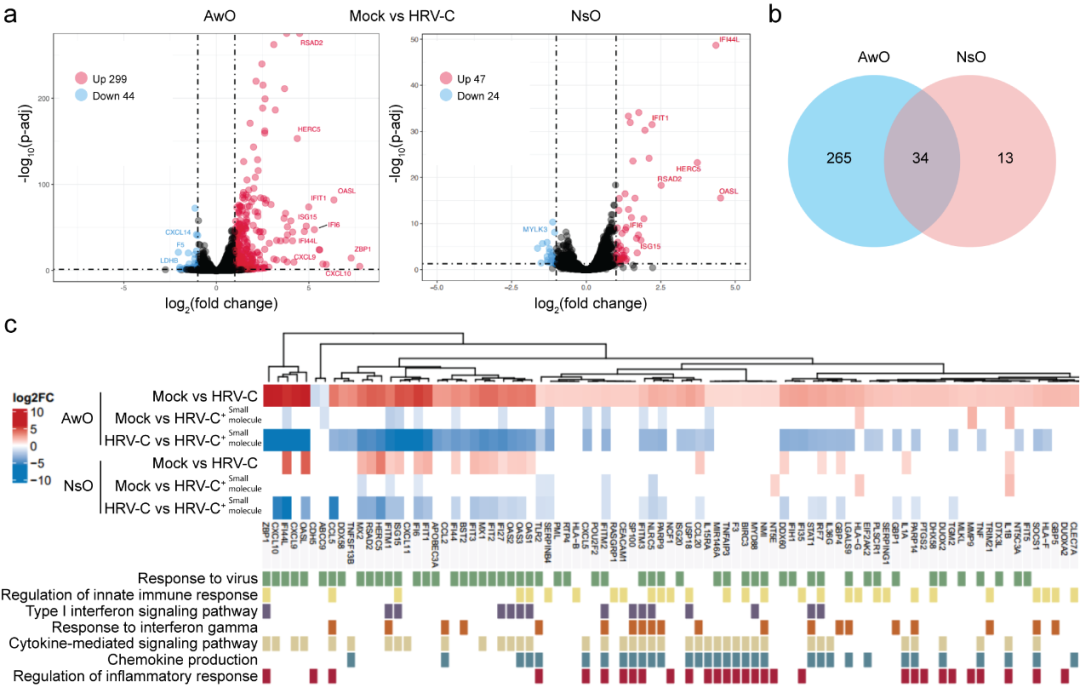
图5. 气道类器官具有更强的先天免疫反应
基于呼吸道类器官对HRV-C的高易感性,研究团队进一步探索了该模型在抗体阻断实验和药物筛选中的应用。结果证实,阻断CDHR3受体可显著抑制HRV-C的复制(图6a);芦平曲韦(Rupintrivir)和伊曲康唑(Itraconazole)可有效抑制HRV-A和C在类器官中的复制,且对于HRV-C的抑制效果较HRV-A明显(图6b)。
此外,该团队还开发了一种基于类器官的HRV-C感染粒子定量的方法。该方法利用呼吸道类器官对HRV-C的高度易感性,通过免疫荧光染色和高通量共聚焦成像,可以准确定量出HRV-C的感染性粒子的数量(图6c)。这些结果表明,这一全新的基于类器官的HRV-C感染模型可以用于疫苗和抗病毒药物的研究和开发。
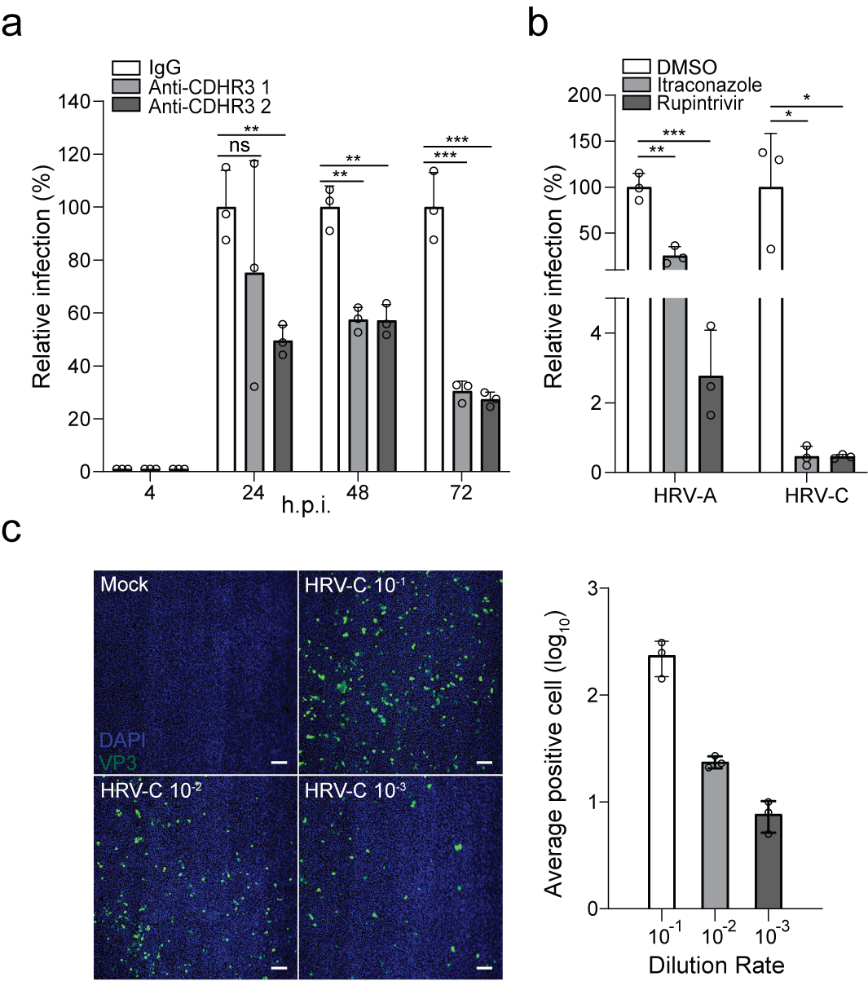
图6. 基于呼吸道类器官的抗体阻断、抗病毒药物筛选和病毒滴定应用
香港大学李嘉诚医学院微生物系周婕教授为论文通讯作者,香港大学李嘉诚医学院微生物系研究助理教授李存博士,俞亦飞博士为该论文的第一作者。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


